Важнейшим звеном в исследованиях патогенеза годов нового класса лекарственных препаратов
при хронической сердечной недостаточности (ХСН) явилось
открытие в 70-80-е годы прошлого столетия ключевой роли периферического вазоспазма как главного механизма поддержания адекватного перфузионного давления в жизненно важных органах в условиях падающего сердечного выброса. Однако длительно существующая повышенная пост-, а затем и преднагрузка на сердце (артериолярная и венозная вазоконстрикция) со временем сами становятся причиной и/или
движущей силой еще большего повреждения сердечной мышцы и прогрессирования ХСН.
Эта теоретическая предпосылка открыла "новую эру" в лечении декомпенсированных больных -
эру периферических
вазодилататоров и
сконцентрировала внимание исследователей на изучении симпатико-адреналовой и особенно ренин-ангиотензин-альдостероновой (РААС) нейрогуморальных систем, ответственных за системную вазоконстрикцию. Поиск более эффективных "нейрогуморальных" периферических вазодилататоров привел к созданию в середине 70-х
годов нового класса лекарственных
препаратов - ингибиторов
ангиотензинпревращающего
фермаента (АПФ). Сосудистый
эндотелий - универсальный регулятор тонуса сосудовТеоретически блокада а-адренорецепторов сосудов
или ингибиторов синтеза ангиотензина II
(All) у больных с ХСН должна приводить к уменьшению
системной вазоконстрикции и увеличению периферического кровотока. Однако результаты некоторых клинических испытаний как а-блокаторов
[I], так и ингибиторов АПФ [2] у больных с ХСН этого не подтвердили. Так, в исследовании Н. Drexler и соавт. [2] острое
введение ингибитора АПФ цилизаприла пациентам с декомпенсацией приводило к вполне ожидаемому снижению уровня АН в плазме крови с 25 до 9,9 пг/мл. Тем не менее столь значительное ослабление вазоконстрикторного пресса не сопровождалось ростом периферического кровотока в мышцах ног или увеличением потребления кислорода при нагрузке
[I]. Отсутствие
100% контроля за сосудистым тонусом с помощью одних центральных нейрогуморальных стимулов свидетельствовало о том, что напряжение сосудистой стенки регулируется также другими, в частности локальными, механизмами.
Впервые о самостоятельной роли сосудистого эндотелия в регуляции сосудистого тонуса было заявлено в статье
R. Furchgott и J. Zawadzki в 1980 г. [З]. Авторы обнаружили способность изолированной артерии к самостоятельному изменению своего мышечного тонуса в ответ на ацетилхолин без участия центральных (нейрогуморальных) механизмов. Главная роль в этом отводилась эндотелиальным клеткам, которые были охарактеризованы авторами как "сердечно-сосудистый эндокринный орган, осуществляющий связь в критических ситуациях между кровью и тканями" [З].
В последующие 20 лет было доказано, что эндотелий - это не пассивный барьер между кровью и тканями, а активный орган, дисфункция которого является обязательным компонентом патогенеза практически всех сердечно-сосудистых заболеваний, включая атеросклероз, гипертонию, ИБС, ХСН, он участвует также в воспалительных реакциях, аутоиммунных процессах, сахарном диабете, тромбозе, сепсисе, росте
злокачественных опухолей и т.д.
Механизм участия эндотелия в возникновении и развитии различных патологических состояний по сей день вызывает интерес и до конца не выяснен. В упрощенном виде можно выделить три основных стимула, вызывающих "гормональную" реакцию эндотелиальной клетки
:
- изменение скорости кровотока (увеличение напряжения сдвига);
- тромбоцитарные медиаторы (серотонин, АДФ, тромбин);
- циркулирующие и/или "внутристеночные" нейрогормоны (катехоламины, вазопрессин, ацетилхолин, эндотелин, брадикинин, гистамин и др.).
Действие медиаторов и нейрогормонов осуществляется через специфические рецепторы, расположенные на поверхности клеток эндотелия. Ряд веществ
(арахидоновая кислота, А-23187) воздействует на эндотелиальную клетку, минуя рецепторы, непосредственно через клеточную мембрану.
В норме в ответ на эти стимулы клетки эндотелия реагируют усилением синтеза веществ, вызывающих расслабление гладкомышечных клеток сосудистой стенки, в первую очередь оксида азота
(NO) и его дериватов (эндотелиальные факторы релаксации - ЭФР), а также простациклина и эндотелийзависимого фактора гиперполяризации. Важно отметить, что влияние ЭФР-NO не ограничивается дилатацией локального участка, он оказывает также антипролиферативное влияние на гладкомышечные клетки сосудистой стенки. Кроме того, в просвете сосуда этот комплекс дает ряд важных системных эффектов, направленных на защиту сосудистой стенки и предупреждение тромбообразования: блокирование агрегации тромбоцитов, окисления липопротеидов низкой плотности, экспрессии молекул адгезии, "прилипания" моноцитов и тромбоцитов к стенке сосуда, продукции эндотелина и т.д.
В определенных ситуациях (например, при острой гипоксии) клетки эндотелия, напротив, становятся "причиной" вазоконстрикции как за счет снижения продукции ЭФР-NO, так и вследствие усиленного синтеза веществ с вазоконстрикторным эффектом - эндотелиальных факторов констрикции: сверхокисленных анионов, вазоконстрикторных простаноидов типа тромбоксана Ау а также эндотелина-1 и др.
При длительном воздействии различных повреждающих факторов (гипоксия, интоксикация, воспаление, гемодинамическая перегрузка и т.д.) происходят постепенное истощение и извращение компенсаторной "дилатирующей" способности эндотелия и преимущественным "ответом" эндотелиальных клеток на обычные же стимулы становятся вазоконстрикция и пролиферация.
Важнейшим фактором эндотелиальной дисфункции является хроническая гиперактивация РААС.
Эндотелий и РААС
Огромное значение эндотелия в развитии сердечно-сосудистых заболеваний вообще и ХСН в частности вытекает уже из того, что основная часть АПФ расположена на мембране эндотелиальных клеток. По данным
V. Dzau [4], 90% всего объема РААС приходится на органы и ткани (10% - на плазму), среди которых сосудистый эндотелий занимает первое место, поэтому гиперактивация РААС является непременным условием эндотелиальной дисфункции.
Участие АПФ в регуляции сосудистого тонуса реализуется через синтез
All, оказывающего мощное вазоконстрикторное влияние посредством стимуляции АТ,-рецепторов гладкомышечных клеток сосудов. Другой механизм, более сопряженный собственно с эндотелиальной дисфункцией, связан со свойством АПФ ускорять деградацию брадикинина. Повышение активности АПФ, расположенного на поверхности эндотелиальных клеток, катализирует распад брадикинина с развитием его относительного дефицита. Отсутствие адекватной стимуляции брадикининовых В^-рецепторов клеток эндотелия приводит к снижению синтеза ЭФР-NO и повышению тонуса гладкомышечных клеток сосудов.
Потенциальные механизмы эндотелиальной дисфункции при ХСН
Среди известных механизмов участия эндотелиальной дисфункции в патогенезе ХСН можно выделить следующие основные:
- повышение активности эндотелиального АПФ, сопровождающееся увеличением синтеза АН и ускорением распада (ослаблением влияния) брадикинина;
- подавление экспрессии/инактивация эндотелиальной ./VO-синтазы и снижение синтеза
NO, обусловленные:
-
а) хроническим снижением кровотока и извращением реакции сосудов на "напряжение сдвига";
-
б) повышением уровня провоспалительных цито-кинов и фактора некроза опухоли (ФНО-сх), подавляющих синтез
NO;
-
в) увеличением концентрации свободных 7Р ), инак-тивирующих ЭФР-NO;
-
г) повышением уровня циклооксигеназозависи-мых эндотелиальных факторов констрикции, "компенсирующих" дилатирующее влияние ЭФР-NO;
-
д) снижением чувствительности и регулирующего влияния мускариновых рецепторов;
- повышением уровня эндотелина-1, оказывающего собственное вазоконстрикторное и пролифера-тивное действие.
Ингибиторы АПФ при эндотелиальной дисфункции:
экспериментальные данные
Один из реальных путей воздействия на эндотелиальную дисфункцию связан с восстановлением нарушенного у больных с сердечно-сосудистыми заболеваниями метаболизма брадикинина. Блокада тканевого (эндотелиального) АПФ, которая может быть достигнута путем применения ингибиторов АПФ, приводит
не только к уменьшению синтеза АН, но и к замедлению деградации брадикинина, причем наибольший "успех" в этом направлении имеют ингибиторы АПФ, которые обладают наибольшей аффинностью к тканевой (эндотелиальной) РААС.
Среди известных ингибиторов АПФ наибольшее сродство к тканевой РААС имеет квинаприлат (активный метаболит
квинаприла), который по показателю тканевой аффинности в 2 раза превосходит периндоприлат, в 3 раза - рамиприлат и в 15 раз - эналаприлат.
Экспериментальные исследования на мышиной модели ХСН показали, что применение квинаприла ассоциируется с улучшением функционирования В2-брадикининовых рецепторов эндотелиальных клеток. Этот вывод был сделан на основании того факта, что в эндотелии сосудов при использовании этого препарата обнаруживались повышение активности тканевого фермента
NO-синтазы и увеличение продукции самого
NO, которые частично устранялись одновременным применением вещества HOE-IQ4, являющегося специфическим блокатором
B2-брадикининовых рецепторов эндотелиальных клеток [б]. Эти данные свидетельствуют о том, что квинаприл восстанавливает работоспособность эндотелия как путем нормализации метаболизма брадикинина, так и за счет улучшения рабочих характеристик В2-брадикининовых рецепторов [7]. Исследования, проведенные в клинике у 10 добровольцев, полностью подтвердили существенную роль брадикининового механизма в действии этого препарата: инфузия квинаприла сопровождалась увеличением диаметра лучевой артерии в ответ на пробу с гиперемией; сочетанное применение квинаприла с икатибантом (НОЕ-104) - блокатором
B2-брадикининовых рецепторов - полностью нивелировало этот дилатирующий эффект [8].
Механизм положительного действия квинаприла на дисфункцию эндотелия связан не только с модулирующим его влиянием на метаболизм брадикинина и улучшением функции Дд-рецепторов, но также со способностью этого препарата восстанавливать нормальную деятельность других рецепторных систем, в частности мускариновых (М) рецепторов. Восстановление вазодилатирующего эффекта ацетилхолина, реализующегося через стимуляцию Af-рецепторов эндотелия, на фоне длительного применения квинаприла наблюдалось в исследованиях на кроликах [9] и в клинике [10]. Важно отметить, что использование ингибиторов АПФ, не обладающих высокой тканевой аффинностью, не оказывало такого действия [9].
Как указывалось выше, стимуляция "восстановленных" квинаприлом М-и
B2-рецепторов эндотелия у больных с сердечно-сосудистыми заболеваниями приводит к опосредованной дилатации артерий за счет рецепторзависимого увеличения синтеза ЭФР-NO. Однако существуют доказательства того, что квинаприл оказывает прямое модулирующее влияние на синтез ЭФР-NO. Подтверждение этому было получено в ставшем уже "классическим" исследовании В. Horing и соавт. [ 11 ]. У 40 больных с ХСН проводилась проба с реактивной гиперемией предплечья. Обязательная при этом дилатация сосудов (потокзависимая дилатация) на втором этапе исследования блокировалась специфическим веществом -
N-моноэтил-L-аргинином (L-NMMA). L-NMMA является прямым ингибитором синтеза NO и блокирует эндотелиальный 7VO-зависимый механизм дилатации артерий. На
рис. 1 видно, что внутриартериальная инфузия квинаприлата восстанавливала нормальную реакцию артерии на гиперемию, блокированную ранее с помощью
L-NMMA: диаметр сосуда возрастал более чем на 100% по сравнению с контролем (5,6% против 2,5%; р<0,01). Очевидно, что механизм положительного действия квинаприлата в этом случае был связан со значительным повышением уровня эндогенного NO и восстановлением
NО-зависимой дилатации, блокированной
L-NMMA. Важно отметить, что другой ингибитор АПФ - эналаприл, как и плацебо, не оказывал подобного действия.
р<0,01
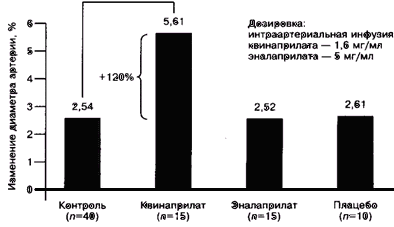
Рис.1.
Квинаприл восстанавливает NO-зависимую
дилататцию артерий
(блокированную L-NMMA) при реактивной гиперемии у больных с ХСН.
Ингибиторы АПФ при эндотелиальной дисфункции: клинические данные
Существуют многочисленные подтверждения благоприятного действия квинаприла у больных артериальной гипертонией, атеросклерозом, ИБС. Исследования квинаприла при ХСН не столь многочисленны, но также свидетельствуют о высокой клинической эффективности этого препарата. Так, в работе
G. Riegger [12] 12-недельное двойное слепое плацебо-контролируемое применение квинаприла у 225 больных с клинически выраженной ХСН на фоне традиционной терапии диуретиками и гликозидами приводило к
достоверному улучшению функционального состояния пациентов (70% улучшения против 45% в группе плацебо; р<0,05) при минимуме побочных эффектов. Аналогичные положительные результаты применения квинаприла при ХСН были получены в многоцентровом исследовании, проведенном в Великобритании [13]. Кроме того, в ряде работ было доказано, что по клинической эффективности и безопасности у больных с декомпенсацией квинаприл не уступает другим ингибиторам АПФ, в частности каптоприлу [14].
Помимо чисто клинических аспектов, эти исследования объединяло признание того факта, что при терапевтическом использовании квинаприла у больных с ХСН существенно повышалась толерантность к физическим нагрузкам. Этот эффект может быть прямым следствием выраженной способности квинаприла восстанавливать при длительном применении нарушенную у этих больных эндотелиальную функцию периферических артерий и повышать кровоток в попе-речнополосатой мускулатуре.
Преимущество ингибитора АПФ квинаприла перед препаратами других классов по влиянию на дисфункцию эндотелия было доказано в открытом рандомизированном многоцентровом перекрестном исследовании BANFF [15]. Терапия каждым препаратом - квинаприлом (20 мг;
n=56), лозартаном (50 мг; n=38), эналаприлом (10 мг;
n=55) и амлодипином (5 мг; n=45) - проводилась в течение 8 нед, прерываясь на 2 нед для "отмывания" перед назначением следующего препарата у больных с неосложненной ИБС. Динамика функции эндотелия оценивалась по изменению поток-зависимой дилатации плечевой артерии. Как видно на
графике, достоверное увеличение потокозависимой дилатации было отмечено только на фоне терапии квинаприлом.
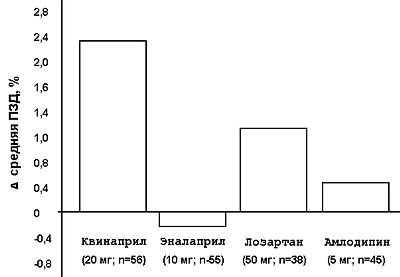
Рис.4.
Сравнение четырех препаратов по влиянию на эндотелиальную функцию у больных ИБС (исследование
BANFF).
ПЗД - потокзависимая дилатация плечевой артерии в ответ на реактивную гиперемию.
Наиболее четкое свидетельство нормализующего влияния квинаприла на эндотелий сосудов, в частности коронарных, было получено в исследовании
TREND, проведенном у 129 нормотензивных больных с подтвержденным коронарным атеросклерозом и без признаков ХСН [10]. Терапия квинаприлом (40 мг) в течение 6 мес привела к полному восстановлению нормальной реакции коронарного русла в ответ на инфузию ацетилхолина. К сожалению, в более позднем исследовании QUIET квинаприл не подтвердил ожидаемого эффекта в снижении частоты рестенозов коронарных артерий [16]. Однако восстановление функции коронарного эндотелия на фоне применения квинаприла, бесспорно, имеет место и сопровождается улучшением клинического состояния больных ИБС. В исследовании QUO VADIS 148 больных ИБС за несколько дней до операции аортокоронарного шунтирования были рандомизированы в подгруппы активного лечения квинаприлом (40 мг) или плацебо [17]. Через 1 год после операции и непрерывной терапии, несмотря на одинаковый прирост переносимости к нагрузкам, в подгруппе квинаприла наметилась тенденция к уменьшению числа ишемических эпизодов (по данным 48-часового холтеровского мониторирования ЭКГ) и было отмечено достоверное снижение риска развития клинических проявлений ишемии (стенокардии, инфаркта миокарда, острого или транзиторного нарушения мозгового кровообращения). Так, частота указанных ишемических эпизодов в подгруппе квинаприла составила 4% против 18% в подгруппе плацебо (р<0,03).
По мнению ряда исследователей, высокая эффективность квинаприла в лечении артериальной гипертонии, также во многом "обязана" улучшению функции эндотелия, характерному именно для этого ингибитора АПФ [18].
Заключение
Справедливости ради следует отметить, что в некоторых исследованиях способность улучшать функцию эндотелия демонстрируют и другие ингибиторы АПФ, обладающие высокой аффинностью к тканевой РААС, в частности периндоприл [19], рамиприл [20], реже эналаприл [21]. Так, особо впечатляющие результаты были получены в исследовании HOPE [20], в котором терапия рамиприлом 9,5 тыс. больных с высоким риском развития сердечно-сосудистых осложнений привела в среднем к 20- 30% снижению риска сердечно-сосудистой смерти, развития инфаркта миокарда и мозгового инсульта. На 22% уменьшился риск развития сердечной недостаточности. Одним из объяснений столь высокой эффективности лечения явилась способность рамиприла воздействовать на тканевую (эндотелиальную) РААС и эндотелиальную дисфункцию [20].
Таким образом, на рубеже XX века доказано, что в патогенезе сердечно-сосудистых заболеваний вообще
и ХСН в частности особое место занимает эндотелиальная дисфункция. Ведущими гуморальными эндоте-лиальными модуляторами дилатации являются системы брадикинина и ЭФР-TVO. Основная роль эндотелия как нейроэндокринного органа связана с обеспечением дилатации сосудистого русла, соответствующей потребности периферической мускулатуры и внутренних органов в адекватном нагрузкам кровоснабжении. Основные причины развития эндотелиальной дисфункции при ХСН многообразны и связаны главным образом с длительно существующей гемодинамической перегрузкой проводящих артерий (высоким напряжением сдвига), гиперактивацией РААС, симпатико-адреналовой и ряда других нейрогуморальных систем, что проявляется извращением дилатируюшей реакции эндотелия на обычные стимулы, нарушением образования или блокадой действия систем брадикинина и ЭФР-NO. Наиболее эффективными средствами терапии эндотелиальной дисфункции являются ингибиторы АПФ, преимущество которых связано не столько с уменьшением синтеза
All, сколько с замедлением деградации брадикинина и восстановлением функции рецепторного аппарата эндотелия. Среди ингибиторов АПФ наиболее эффективными представляются препараты, обладающие высокой аффинностью к тканевой РААС. Средством выбора в устранении эндотелиальной дисфункции может явиться квинаприл, превосходящий по этому качеству другие ингибиторы АПФ.
ЛИТЕРАТУРА
1. LeJmtel Т.Н., Modern C.S., Lucido D. etal. Failure to augment maximal limb blood How in responce to one leg versus two-leg exercise in patients with severe heart
failure. Circulation 1986;7444:245-251.
2. Drexler H., Kanhardt U.,Meifierti T. et a/. Contrasting peripheral short-term and long-term effects of converting enzyme inhibition in patients with congestive heart failure. A double-blind, placebo-controlled trial. Circulation 1989,79:491-502.
3. Furchgott R. F., Zawadfki J. V. The obligatory role of the endothelial cells in relaxation of arterial smooth muscle by acetylcholine. Nature 1980:288:373-3\6.
4. Dwu V.J. Tissue renin-angiotensin system in myocardial hypertrophy and failure. Arch lnte\n Med 1993,153:937-942,
5. Fabris В., Cfien В.. Pupic\ V. et al. Inhibition of angiotensin-converting enzyme
(ACE) \f\ plasma and tissue. J Cardiovasc Pharmacol 1990:15:Suppl
2:^6-S13.
6. Ferrari R., Bachetti Т., Guardigli G. et al. Bradykinin and coronary artery
disease. Eur Heart J 200^:2:Suppl H:H14-H19.
7. Vanhoutte P.M., Boulanger C.M\ Illiano S.C. et al. Endothelium-dependent effects of converting ftnzyme inhibitors. J Cardiovasc Pharmacol 1993;22:Suppl 5:SIO-S16.
8. Holing C., Kohler C., Drexler H. Rble ofbradykinin in mediating vascular effects of ACE inhibitors tp humans. Circulation 1997;
9. Fabre J.-E., Rivard A., Magner M. rt al. Tissue inhibition of angiothensin - converting enzyme activity simulates angiogenesis in vivo. Circulation 1999:99:3043-3049-,
10. Mancini G. B.J., HenryG.C., Macaya C.f/ri.Angiotensin-converting enzyme inhibition with quinapril improves endothelial vasomotor dysfunction in patients with coronary artery disease. The TREND (Trial on Reversing Endothelial Dysfunction) study. Circulation 1996:94:258-265. \
11. Horing В., Arakawa N.. Haussmann D. el al. Differential effects of quinaprilat and enalaprilat on endothelial function of conduit arteries in patients with chronic heart
failure. Circulation 1998;
12. Riegger G.A.J. Effects of quinapril on exercise tolerance in patients with mild to moderate heart failure. Eur Heart J 1991:12:705-711.
13. Northridge D.B., Rose E., Raftery E.D. et al. A multicentre, double-blind, placebo-controlled trial of quinapril in mild, chronic heart failure. Eur Heart J 1993:14:403-409.
14.
Beynon J.H., Pathy M.S.J. An open, parallel group comparison of quinapril and
captopril, when added to diuretic therapy, in the treatment of elderly patients with heart
failure. Curr Med Res Opin 1997:13:583-592.
15.
Anderson T.J., Elstein E., Haber H. etal. Comparative study
ofACE-Inhibition, angiotensin II antagonism, and calcium channel blockade on flow mediated vasodilatation in patients with coronary disease
(BANFF Study). J Am Coil Cardiol 2000:35:60-66.
16. Lees R.S., Pitt В., Chan R. C. etal. Baseline clinical and angiographic data in the Quinapril Ischaemic Event Trial
(QUIET). Am J Cardiol 1996:78:1011-1016.
17. Oosterga M., VoorsA.A., Buikema H. el al. Angiotensin II formation in human vasculature after chrome ACE inhibition: a prospective, randomized, placebo-controlled study. Cardiovasc Drugs Ther 2000:14:55-60.
18. Canter D., Frank G.J., Knapp L.E. elal. Quinapril and hydrochlor-thiazide combination for control of\ hypertension: assessment by factoral design. J Human Hypert 1994:8:155-162.
19. Antony /., Lerebours G. et al. Angiotension converting enzyme inhibition restores flow-dependent and^ cold pressor test-induced dilatations in coronary arteries ofhypertensive
patients. Circulation 1996:94:3115-3122.
20. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting enzyrtae
inhibitor, ramipril, on cardiovascular events in high-risk
patients. N Engi J Med 2000:342:145-153.
21. Prasad A., Husain S. et al. Coronary endothelial dysfunction in humans improves with angiotension converting enzyme inhibition. Circulation 1996;94:Suppl 1 Abstract 1:61.
Поступила 05.02.2001
КАРДИОЛОГИЯ (KARDIOLOGIYA), 5, 2001
|





